多年来,随着抗生素的滥用,与抗生素耐药基因相关的细菌疾病成为了危害人类健康的问题之一,因此,人们迫切需要找到一种新的细菌治疗方法,能够克服抗生素耐药、制备复杂、成本高等缺点,取代传统的抗生素疗法。近年来,随着纳米生物材料的发展,纳米抗菌剂的研究成为热点,特别是含铜纳米酶,它可以模拟天然酶的功能,通过催化作用产生活性氧(ROS),具有高效的杀菌作用。铜因其优良的抗菌效果,在各医疗卫生机构中应用历史悠久。开发含铜抗菌素被认为是应对不断加剧的全球抗生素耐药性危机的一个潜在解决方案。含铜纳米酶具有优异的广谱抗菌性能和低耐药可能性,有望成为一种新型的抗菌纳米酶。
近日,材料学院陈克正教授、王玮教授与中国医学科学院放射医学研究所刘鉴峰研究员(材料学院特聘教授)合作,在含铜抗菌纳米酶的研究方面取得重要突破,并在青岛科技大学高质量论文认定期刊源、中科院一区Top期刊ACS Applied Materials & Interfaces(影响因子8.758)发表标题为“Effective Antibacterial Activity of Degradable Copper-doped Phosphate-based Glass Nanozyme”的高水平论文,材料学院2018级硕士研究生刘一凡和聂宁为该论文的共同第一作者。
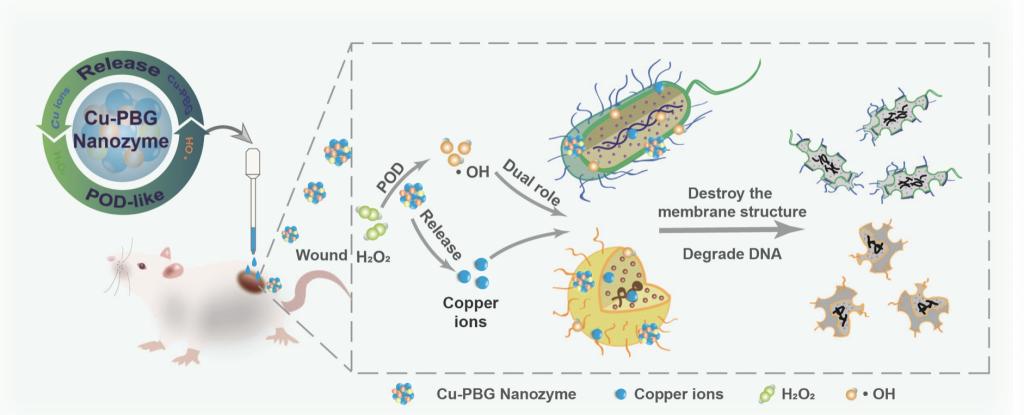
团队成员通过简易的水热法制备非晶可降解含铜磷酸盐玻璃(Cu-PBG)纳米酶,该纳米酶在体内和体外对革兰氏阳性菌和革兰氏阴性菌均有良好的抗菌效果。研究指出,Cu-PBG纳米酶的抗菌机制是基于活性氧(ROS)风暴的产生和铜离子的释放。在微酸性伤口组织中Cu-PBG纳米酶表达过氧化物酶(POD)活性,通过催化H2O2分解为羟基自由基(·OH),对细菌产生致命的氧化应激杀伤。而在中性的生理环境中,则表达过氧化氢酶(CAT)活性,避免了氧化应激对正常组织的损伤。与传统的纳米酶不同,Cu-PBG纳米酶由于其磷酸盐玻璃性质,本质上是可降解的。在微酸性和中性的生理环境中都可实现降解,并释放铜离子,进一步提高了细菌杀伤效果,且避免了无机纳米粒子在体内的长期滞留,具有优秀的生物相容性。体内伤口愈合实验结果也证明了其优秀的体内杀菌、消退炎症、促进伤口愈合的性能。该工作合成了一种高效的含铜抗菌药物,具有巨大的临床转化潜力,对探索新型含铜抗菌剂和开发新的抗菌策略具有重要意义。
文章链接:https://pubs.acs.org/doi/10.1021/acsami.0c22746
本工作得到了国家优青基金、国家自然科学基金、山东省自然科学基金等项目的资助。

